Organización de las macromoléculas y el origen de las células.
las unidades elementales se clasifican, sobre la base de consideraciones geométricas simples, en: a)unidimensionales(fibrosas), cuando las moléculas están asociadas linealmente a lo largo de un solo eje; b) bidimensionales(membranosas) si existen en dos dimensiones formando finas membranas y c) tridimensionales, cuando constituyen partículas cristalinas o amorfas. en ciertos sistemas las estructuras supramoleculares pueden agregarse para formar tipos superiores de organización, visibles con el microscopio y aun a simple vista. existe una serie de componentes con este tipo de composición, tanto de tejidos vegetales y tejidos animales. se dividen en 3 categorías:
- 9 Subcelulares, que abarcan partes de la células como cilios y cromosomas.
- Extracelulares,como las fibras colágenas y elásticas, y las membranas de celulosa y quitina situadas por fuera de la célula.
- Supracelulares, que comprenden formaciones microscópicas como el pelo, hueso, y musculo, en las cuales existe una organización supramulecular mas completa.
imagen referente ala organización de la célula
Las proteínas y el ácido nucleico tienen la propiedad de autoensamble.
puede producirse el autoensamble (assembly) de algunas proteínas oligomnericas, como la hemoglobina. en el auto ensamble las subunidades proteicas contienen la información necesaria para producir el complejo mayor por medio de uniones secundarias. A demás del autoensamble simple, en el que no interviene ,otro componente existe tambien el principio de autoensamble dirigido en la cual algunas enzimas pueden preparar a las macromoleculas para su agregación.
propiedades de auto-ensamble en proteínas y ácidos nucleicos
El origen de la célula
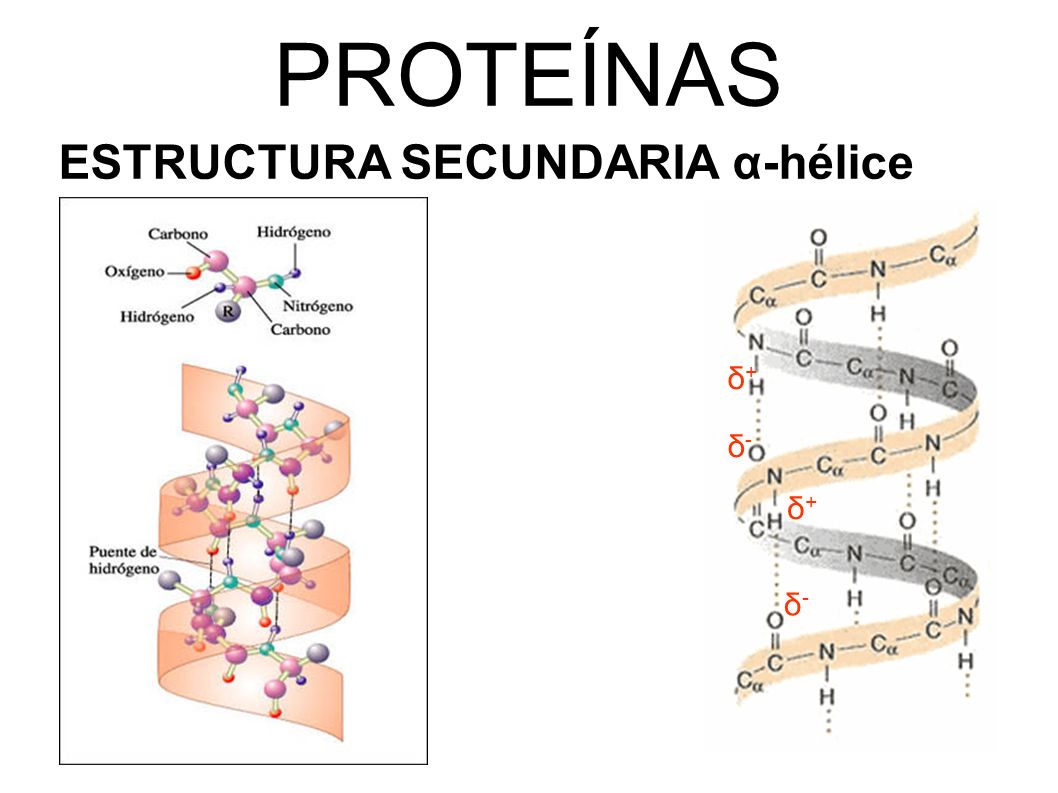
En su libro azar y necesidad (cuya lectura se recomienda)monod se considera muchos de los conceptos desarrollados aquí , en el capitulo (ontogenesis molecular.en el se destaca que la causa por la cual se forman en la celula estructura de un orden debe buscarse finalmente en la informacion contenida en el ADN. Esta es la que determina la secuencia primaria de la cadena polipeptidica de la proteína ,que a su vez determina las estructuras secundarias y terciarias y la función de complejos oligomericos cuaternarios.
A que no se conoce como se formaron las primeras células, es posible establecer por medio del registro en fósiles procariontes presidieron a los eucariontes y aparecieron hace 3,5-3,0 x 10 a la 9 potencia años .Recientes observaciones demostraron que solo después de 1000 millones de años de haberse formado la tierra (es decir aproximadamente 3,5 x 10 ala 9 potencia años atras ).
origen de la célula
La evolución química produjo moléculas orgánicas que contenían carbono
En los tiempos previoticos,es decir, anteriores al origen de la vida la atmósfera de la tierra carencia de oxigeno , como sucede en jupiter y saturno en la actualidad. Contenian , principalmente, hidrógeno,nitrógeno,amoniaco(NH3), metano(CH4)monoxido de carbono(CO).También el agua, en forma de vapor cubría parte de la superficie terrestre, aunque normalmente estas moléculas son pocos reactivas podía ver interaccionado gracias ala energía provista por la radiación ultravioleta,calor y las descargas eléctricas(rayos).
Los mecanismos de agregación formaron los primitivos proteinoides
El próximo paso fue probablemente de los aminoácidos para construir proteínas lo cual pudo ser posible por la acción catalica de arcillas.Todos estos procesos pueden haberse producido en medios acuosos(lagunas)en los cuales las moléculas orgánicas se concentraron formando una especie "caldo" en el que se favorecieron las reacciones moleculares.
la secuencia primaria de aminoácidos origina la estructuras proteicas secundarias,terciarias, y-con la formación de oligomeros-aun las cuaternarias .
Las células procariotas precedieron a las eucariotas
Parece probable que el ARN , y no el ADN fuese el material genético primordial de modo que desde un punto de vista cronológico las macromoleculas abrían evolucionado así:
ARN →ADN
↓
PROTEÍNAS
Era mas simple comenzar con el ARN porque puede usarse como materia genético y también como ARN mensajero . La mayoría de los pasos clave de la maquinaria de la síntesis proteica depende de interacción ARN-ARN.
Es posible que los primeros procariontes heterotroficos(es decir que se nutren de las moléculas orgánicas).Mas tarde aparecieron algunos procariontes automáticos,como las algas azules,que tenían pigmentos fotosíntesis. Gracias a la fotosíntesis se produjo y se acumulo el oxigeno en la atmósfera,con lo que fue posible la formación de células aerobias procariontes.
Después de la aparición de los procariontes autotroficos pudo haberse originado de la célula eucariota de acuerdo con los restos fósiles, los organismos eucariontes deben haber aparecido 1.500-1.400 millones de años atrás cuando se había establecido una atmósfera de oxigeno estable y los organismos podían ser totalmente aerobicos.
La invension del sexo unos 2000 millones de años atras, acelero la evolución de las formas viventes que , hasta entonces,era relativamente lenta, el sexo hizo posible el intercambio de in formación genética entre individuo y por mutucion y selección, producir un numero considerable de diferentes formas vida que hoy se encuentran en nuestro planeta