un aminoacido es un acido organico en el cual el carbono proximo al grupo-COOH (llamado carbono alfa) esta unido tambien a un grupo-NH2. Ademas, el carbono alfa se une a una cadena lateral (R), que es diferente para cada aminoacido.
La unión-NH-CO-se conoce como union peptidica o puente peptidico.Una combinacion de dos aminoacidos constituye un dipeptido, de tres; un tripeptido;cuando se unen entre si unos pocos aminoácidos,el compuesto es un oligopeptido.
un polipeptido esta formado por muchos aminoacidos(a veces hasta 1000 o mas).
 |
| Esta imagen es un ejemplo de cadena lateral |
El termino proteina ( de griego proteuo,yo ocupo el primer lugar) indica que todas las funcones basicas en biología dependen de las proteínas, se puede decir que no existe vida sin proteinas.
ellas están presentes en cada célula y en cada organoide celular.Constituyen las enzimas, la maquinaria contractil de la célula y se encuentran en la sangre y en otros líquidos intercelulares.
Cuatro niveles de la estructura proteica.
Por lo común se diferencian cuatro niveles de estructura de las proteínas.
La estructura primaria: Es la secuencia de aminoácidos que forma una cadena ligada por uniones peptidicas. La secuencia de aminoácidos de una proteína determina el nivel mas importante en la estructura de la molécula. La importancia biológica de la secuencia de aminoácidos encuentra un ejemplo en la enfermedad humana hereditaria anemia falciforme, en la cual se producen profundos cambios biológicos por la sustitucion de un solo aminoácido en la molécula de hemoglobina.
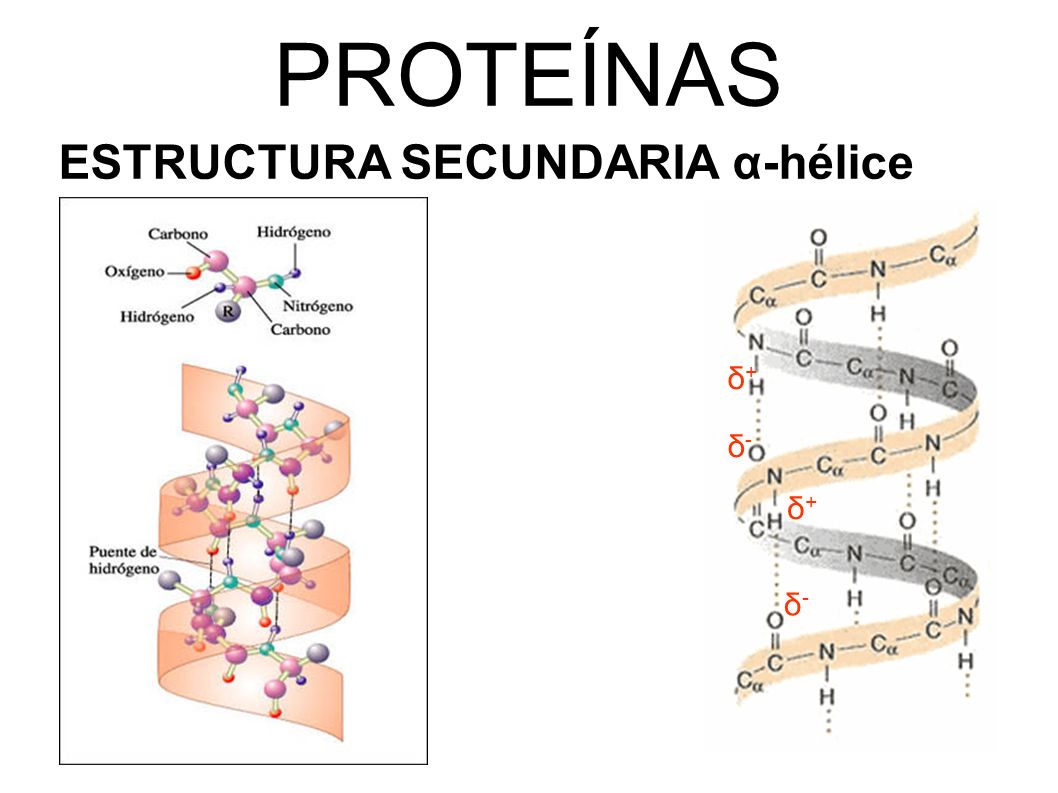 |
| Cadena peptidica o hélice α |
La estructura cuaternaria: Es la disposicion de subunidades proteicas en proteinas complejas formadas por dos o mas de dichas subunidades.
Factores que determinan la estructura de las proteínas.
La disposicion espacial de una molecula proteica, Se halla predeterminada por la secuencia de aminoacidos (estructura primaria). Esto puede demostrase por medio de experimentos en los cuales se produce la desnaturalizacion, o desorganizacion de la estructura terciaria de una proteina, por medio de altas temperaturas u otras condiciones no fisiologicas. La desnaturalizacion de una proteina provoca,generalmente,la perdida de su actividad biologica.
 |
| Desnaturalizacion de una proteína |

| Cuando la proteína no ha sufrido ningún cambio en su interacción con el disolvente, se dice que presenta una estructura nativa Se llama desnaturalización de las proteínas a la pérdida de las estructuras de orden superior (secundaria, terciaria y cuaternaria), quedando la cadena polipeptídica reducida a un polímero estadístico sin ninguna estructura tridimensional fija. |
- cambios en las propiedades hidrodinámicas de la proteína: aumenta la viscosidad y disminuye el coeficiente de difusión
- una drástica disminución de su solubilidad, ya que los residuos hidrofóbicos del interior aparecen en la superficie
- pérdida de las propiedades biológicas
Los agentes que provocan la desnaturalización de una proteína se llaman agentes desnaturalizantes. Se distinguen agentes físicos (calor) y químicos (detergentes, disolventes orgánicos, pH, fuerza iónica). Como en algunos casos el fenómeno de la desnaturalización es reversible, es posible precipitar proteínas de manera selectiva mediante cambios en:
- la polaridad del disolvente
- la fuerza ionica
- el pH
- la temperatura
Las proteínas tienen cargas positivas y negativas, pero en el punto Isoeléctrico la carga neta es cero
Además de los grupos terminales cargados eléctricamente, NH3+ y COO-, las proteínas contienen aminoácidos diamínicos y dicarboxílicos, que se disocian así:
1. Los grupos acídicos pierden protones y se cargan negativamente. Este tipo se encuentra en los aminoácidos dicarboxílicos, como los ácidos aspártico y glumático, en los cuales el grupo carboxilo libre se disocia en -COO- + H+.
2. Grupos básicos, que por ganancia de protones se cargan positivamente -NH2 + H+➝NH3+.
Este tipo se encuentra en los aminoácidos con dos grupos dibásicos, como lisina y arginina, en los que los grupos amino libres pueden ionizarse con cargas positivas. Todos estos grupos, llamados ionogénicos, que contribuyen a las reacciones ácido-base de las proteínas y a las propiedades eléctricas de estas moléculas.
La carga real de una molécula proteica es el resultado de la suma de todas las cargas. Como la disociación de los diferentes grupos ácidos y básicos se produce a diferentes concentraciones de iones hidrógeno del medio, el pH influye en gran medida sobre la carga total de la molécula.
 |
| La ionización de las proteínas depende del pH. Con las electroforesis, las proteínas en medio ácido van hacia el cátodo, y en medio alcalino, hacia el ánodo. |
Existe un pH definido para cada proteína en el cual la suma de las cargas positivas y negativas es cero. Este pH se denomia punto isoeléctrico (pI). En el punto isoeléctrico las proteínas colocadas en un campo eléctrico no emigran a ninguno de los dos polos, mientras que a pH mas bajo se desplazan hacia el cátodo y a pH mas alto lo hacen hacia el ánodo, llamándose el conjunto de estos movimientos electroforesis.
En la técnica llamada de enfoque isoeléctrico se hace la electroforesis de las proteínas a través de un gradiente de pH. Las proteínas se desplanzan hasta que alcanzan un pH igual al del punto esoeléctrico. En este momento la migración en el campo eléctrico se detiene porque la proteína tiene carga cero.
Cuando a una proteína se le agrega el detergente iónico dodecilsulfato de sodio (SDS), las proteínas se separan principalmente por el peso molecular. Esto se debe a que el SDS se une a las proteínas y les confiere gran número de cargas negativas a cauda del sulfato. Se reduce así el efecto de la carga propia de las proteínas y éstas se mueven solo de acuerdo con la masa. Las proteínas mas grandes se retardan respecto de las más pequeñas, porque encuentras más resistencia para atravesar los poros moleculares del gel de poliacrilamida, Las electroforesis de SDS se usa mucho para determinar el pedo molecular de las proteínas.
LAS PROTEÍNAS CELULARES PUEDEN SEPARARSE POR ENFOQUES ISOELÉCTRICO Y POR ELECTROFORESIS EN GELES
En la técnica llamada de enfoque isoeléctrico se hace la electroforesis de las proteínas a través de un gradiente de pH. Las proteínas se desplanzan hasta que alcanzan un pH igual al del punto esoeléctrico. En este momento la migración en el campo eléctrico se detiene porque la proteína tiene carga cero.
Cuando a una proteína se le agrega el detergente iónico dodecilsulfato de sodio (SDS), las proteínas se separan principalmente por el peso molecular. Esto se debe a que el SDS se une a las proteínas y les confiere gran número de cargas negativas a cauda del sulfato. Se reduce así el efecto de la carga propia de las proteínas y éstas se mueven solo de acuerdo con la masa. Las proteínas mas grandes se retardan respecto de las más pequeñas, porque encuentras más resistencia para atravesar los poros moleculares del gel de poliacrilamida, Las electroforesis de SDS se usa mucho para determinar el pedo molecular de las proteínas.

No hay comentarios.:
Publicar un comentario